Leptospirose
Die Leptospirose ist eine weltweit vorkommende Zoonose. Die schraubenförmigen Bakterien der Gattung Leptospira interrogans verursachen eine Erkrankung mit oftmals tödlichem Ausgang.
Akutes Nierenversagen, schwere Lungensymptome und atypische Verlaufsformen mit ausschließlich gastrointestinalen Symptomen prägen die Erkrankung beim Hund.
Es gibt über 260 Serovare, gemeint sind Variationen, von Leptospirosa interrogans. Die für Hunde in Deutschland am bedeutendsten sind die Serovare Grippotyphosa, Australis, Bratislava, Canicola, Icterohaemorrhagiae, Pomona, Sejroe und Saxkoebing.
Die Ausscheidung und Kontamination der Umwelt erfolgt durch den Urin infizierter Tiere. Wildlebende Nagetiere, vor allem Ratten sind die größte Infektionsquelle. Gut 10% der Nagetiere sind mit Leptospiren infiziert. Aber auch Igel, Wildschweine, Eichhörnchen und Füchse stellen eine Infektionsquelle dar.
Eine Infektion findet oft über Kontakt mit Wasser statt, besonders stehende oder langsam fließende Gewässer sind sehr häufig kontaminiert. Eine indirekte Übertragung über Erde, Futter und Schlafstellen ist möglich.
Synonyme
- Hundetyphus (1852, Hofer)
- Weil'sche Krankheit (1886, Weil)
- Stuttgarter Hundeseuche (1899, nach einer Hundeausstellung in Stuttgart erkrankten viele Hunde an akutem Nierenversagen)
Ätiologie
Die Erreger der Leptospirose, Leptospiren sind gramnegative, dünne, bewegliche, fadenförmige Bakterien mit helikaler Windung und hakenförmigen, aufgebogenen Zellenden. Sie haben eine Länge von 10 bis 20 μm und einem Durchmesser von 0,10 bis 0,15 μm. Durch Rotation um die eigene Achse und mithilfe des Axialfilaments sind Leptospiren in der Lage, aktiv durch intakte Schleimhäute in den Wirt einzudringen.
Sie siedeln sich im Zuge einer Bakteriämie in der Niere an, vermehren sich und können dann intermittierend über mehrere Monate bis Jahre mit dem Urin ausgeschieden werden.
Aufgrund der in der äußeren Hülle befindlichen Lipopolysacchariden (LPS) wirken sie stark immunogen, aktivieren Granulozyten, Thrombozyten, die Gerinnungskaskaden und verursachen eine massive Freisetzung von Entzündungsmediatoren (Interleukine, Interferon, TNFα).
Taxonomische Einteilung
In der taxonomischen Einteilung von Leptospiren existieren momentan zwei Klassifizierungssysteme die parallel verwendet werden, aber nicht deckungsgleich sind.
- Serologische Einteilung
Sie beruht auf antigenetischen Unterschieden zwischen einzelnen Leptospirenserovaren. Antigenetisch verwandte Serovare werden dabei zu Serogruppen zusammengefasst. Momentan sind über 250 Serovare, die zu 25 Serogruppen zusammengefasst sind, beschrieben. - Genetische Einteilung
Hier werden die Leptospiren auf der Basis ihrer DNA-Verwandtschaft verschiedenen Genospezies zugeordnet. Basierend auf Sequenzierungsdaten werden die Stämme in 9 pathogene, 6 saprophytäre und 5 sogenannte intermediäre Genospezies (Leptospiren unbekannter Pathogenität) eingeteilt.
Die Leptospirose kommt weltweit vor und wird durch Leptospira (L.) interrogans sensu lato hervorgerufen.
Früher galten vor allem die Serovare Icterohaemorrhagiae und Canicola als Verursacher der caninen Leptospirose. Durch den jahrelangen Einsatz eines bivalenten Impfstoffes, der die beiden genannten Serovare beinhaltete, nahm die Inzidenz der Infektion ab. Da eine Impfung nur eine Immunität gegen Serovare in einer Serogruppe hervorruft, nahm die Inzidenz der durch andere Serovare hervorgerufenen Leptospirose-Fälle zu.
In Deutschland werden bei erkrankten Hunden vor allem die Serovare Grippotyphosa, Bratislava, Australis, Pomona, und seltener andere, wie z.B. Saxkoebing und Sejroe, nachgewiesen. Durch Einsatz von neuen quadrivalenten Impfstoffen nahm die Zahl der diagnostizierten Fälle in den letzten Jahren wieder ab.
Epidemiologie
Die Hauptwirte der unterschiedlichen Serovare
Die Leptospirose kommt bei vielen Wild-, Haus- und Nutztieren sowie beim Menschen vor. Vor allem Mäuse und Ratten, aber auch Wildschweine, gelten als wichtige Reservoirwirte und tragen zu der Verbreitung des Pathogens in der Umwelt bei.
Ein oder mehrere Serovare können gleichzeitig an verschiedene Säugetierspezies angepasst sein. Die sogenannten Reservoirwirte scheiden die Erreger mit dem Urin aus, ohne selbst daran zu erkranken.
Außerhalb des Wirtes vermehren sich Leptospiren nicht, überleben aber bis zu mehrere Monate bei optimalen Bedingungen, wie feuchter und warmer Umgebung (0–25 °C). Im unverdünnten Urin von Fleischfressern überleben Leptospiren allerdings nur kurze Zeit.
Serogruppe
Serovar
Bedeutende Wirte
Australis
Australis
Bratislava
München
Ratte, Schwein
Ratte, Schwein, Pferd, Igel
Ratte, Schwein
Atumnalis
Atumnalis
Bim
Maus
Maus
Ballum
Castellonis
Maus, Eichhörnchen, Opossum
Canicola
Canicola
Hund
Grippotyphosa
Grippotyphosa
Vanderhoedoni
Wühlmaus, Waschbär, Stinktier, Opossum, Bisamratte
Maus, Hamster
Icterohaemorrhagie
Copenhageni
Icterohaemorrhagie
Ratte
Ratte
Pomona
Pomona
Rind, Schwein, Stinktier, Opossum
Sejroe
Hardjo
Rind, Schaf
Mensch
Die meisten Krankheitsfälle beim Menschen sind auf freizeitbedingten Wasserkontakt oder berufliche Exposition zurückzuführen. In Einzelfällen ließ sich aber auch ein Zusammenhang mit der Haltung von Hunden oder als Heimtier gehaltenen Ratten herstellen.
Hunde
Auch klinisch unauffällige nicht geimpfte Hunde scheiden häufig Leptospiren mit dem Urin aus.
Katzen
Auch Katzen können sich infizieren, die Infektionen führen aber meist nicht zu klinischen Symptomen. Katzen mit Freilauf scheiden sogar häufiger Leptospiren mit dem Urin aus als Hunde in denselben Regionen.
Wie kann man sich infizieren?
- Direkte Übertragung
-
- Bisse
- Oralen Aufnahme infizierten Gewebes (Fangen von Nagetieren)
- Transplazentare Übertragung
- Indirekte Übertragung (Überwiegend)
-
- Kontaminierte Umwelt
Die Ausscheidung und Kontamination der Umwelt erfolgt überwiegend durch den Urin infizierter Reservoirwirte. Leptospiren überleben optimal in neutralem oder leicht alkalischem Harn der Pflanzenfresser. Der saure Urin der Fleischfresser setzt die Überlebensfähigkeit des Erregers herab. Leptospiren können aktiv durch intakte Schleimhäute und Hautläsionen in den Organismus eindringen.
Leptospiren überleben besonders gut in stehenden oder langsam fließenden Gewässern mit neutralem oder leicht alkalischem pH und Temperaturen von 0 – 25 °C. Damit erklärt sich das gehäufte Auftreten der Infektionen im Spätsommer und Herbst und eine positive Korrelation der Erkrankungshäufigkeit mit der Niederschlagsmenge. Unter optimalen Bedingungen können Leptospiren wochen- oder monatelang überleben. Badet der Hund in kontaminierten Gewässern oder trinkt aus Pfützen, kann er sich mit Leptospiren infizieren.
- Kontaminierte Umwelt
Pathogenese
Nach dem Eindringen von Leptospiren in den Wirt vermehrt sich der Erreger bereits einen Tag post infectionem im Blut. Anschließend disseminieren Leptospiren in verschiedene Organe, wie Nieren, Leber, Milz, Lunge, Endothel, ZNS, Auge, Muskulatur, Pankreas und Geschlechtsorgane. Durch die massive Vermehrung des Erregers und daraus entstehenden Entzündungsreaktionen kommt es zu Organschädigungen.
Durch den Anstieg spezifischer Antikörper kann der Erreger aus den meisten Organen eliminiert werden.
In der Niere können Leptospiren jedoch weiter persistieren. Sie replizieren in den Nierentubulusepithelzellen und werden mit dem Urin in die Umwelt ausgeschieden. Ohne Therapie bleiben viele Hunde dauerhafte Carrier und Ausscheider!
Klinik
Die Leptospirose wird als Krankheit für unsere Hunde oft unterschätzt, da es auch sehr milde Krankheitsverläufe gibt. Solche Hunde können dann auch lange Leptospiren ausscheiden. Leptospirose ist weit verbreitet. Infiziert sich der Hund, vermehren sich die Leptospiren sofort im Blut und besiedeln von dort aus die Organe, allen voran die Nieren, die Leber und die Lunge. Die Schädigung erfolgt hauptsächlich durch die Vermehrung des Erregers und die Entzündungsreaktion des Körpers.
Der Schweregrad der klinischen Veränderungen ist abhängig von Alter und Immunlage des Wirtes, Umwelteinflüssen, der Pathogenität der infizierenden Serovare und der Menge der aufgenommenen Bakterien. Die Krankheit kommt bei Hunden jeden Alters und jeder Rasse vor.
Initiale Symptome
Im Beginn eher unspezifische Symptome.
- Fieber
- Gerötete Schleimhäute
- Anorexie
- Apathie
- Schmerzhaftes Abdomen
Im weiteren Verlauf
Bei der klinisch manifesten Leptospirose stellen Nieren- und Leberfunktionsstörungen, des Weiteren respiratorische Veränderungen („Leptospiral Pulmonary Hemorrhage Syndrome, LPHS“) sowie Gerinnungsstörungen die Hauptbefunde dar.
- Erbrechen
- Durchfall
- Niere
Eine akute Beeinträchtigung der Nierenfunktion mit verminderter glomerulärer Filtrationsrate entsteht durch die Schwellung der Niere und daraus resultierender verminderter Durchblutung. Dies führt zu -
- Oligurie
- Anurie
- Leber
Die Leber ist nach der Niere das am häufigsten betroffene Organ; die Leptospirentoxine bewirken eine cholestatische Hepatitis. -
- Ikterus an den Schleimhäuten
- Gefäße
An den Gefäßen treten Endothelschäden mit Ödembildung und disseminierte intravasale Gerinnung (DIC) auf, die auch zu Blutungen führen können. - Lunge
Zunehmend häufiger werden wie auch in der Humanmedizin schwere respiratorische Verlaufsformen, Leptospiral pulmonary haemorrhage syndrome (LPHS), beschrieben. Durch die Einwirkung und Anlagerung von Immunkomplexen entstehen Endothelschäden und Alveolarwandschäden, die zu Blutungen in die Lunge und hochgradiger Dyspnoe führen und mit einer hohen Letalität einhergehen. - Schocksymptomatik als mögliche Anzeichen eines Multiorganversagens, unter Umständen mit Herz und Lungenbeteiligung
- SIRS (Systemic inflammatory response syndrome), systemische Entzündungsreaktion durch massive Freisetzung von Entzündungsmediatoren.
-
DIC (Disseminierte intravasale Koagulopathie) ist die Folge von schweren Endothelschäden der Blutgefäße mit Verbrauchskoagulopathie, einer deutlichen Thrombopenie und einer verlängerten Gerinnungszeit.
- Außerdem
-
- Pankreatitis
- Myokarditis
- Uveitis/Retinablutungen
- Abort/Infertilität (selten)
Die beim Menschen häufig vorkommende Meningitis wurde beim Hund bisher nicht beschrieben.
Die Prognose hängt in der Regel vom Erhalt der Nierenfunktion ab.
Inwieweit eine Leptosiproseinfektion zu einer chronischen Nieren- oder Lebererkrankung führen kann, ist nicht geklärt.
Typische Laborbefunde: Blut
- Leukozytose
- Thrombozytopenie
- Anämie
- Erhöhte Leberenzyme
- Bilirubinämie
- Azotämie
- Elektrolytverschiebungen als Folge von Durchfall und Erbrechen
- verlängerte Gerinnungszeiten
Typische Laborbefunde: Urin
- Proteinurie
- Bilirubinurie
- Glukosurie
- Pyurie
- Hämaturie
Im Sediment finden sich
- granulierte Zylinder
- Leukozyten
- Erythrozyten
Prognose
Fälle mit Oligurie, Azotämie, Hyperbilirubinämie und deutlicher Atemnot enden mit einer höheren Wahrscheinlichkeit letal als Fälle mit einer reinen Hepatopathie. Eine Blutungsneigung (Epistaxis, Melaena, Hematemesis, Petechien, Hämaturie) sowie pathologische radiologische Lungenbefunde werden ebenso als schlechte prognostische Faktoren angesehen.
Die Diagnose
Wegen der hohen Ansteckungsgefährdung des Menschen und zum Einleiten einer zielgerichteten Therapie für den Hund ist eine schnelle Diagnose wichtig.
Alle direkten Nachweismethoden (PCR, Anzüchtung) sind nur im Fall eines positiven Ergebnisses beweisend. Der klassische Erregernachweis mittels kultureller Anzucht ist aufgrund der langsamen Wachstumsrate von Leptospiren für die Routinediagnostik zu aufwendig. Mittels PCR kann Leptospiren-DNA bereits in der frühen Phase einer Infektion, vor dem Auftreten der Antikörper zunächst im Blut (Leptospirämie), später im Urin (oder evtl. in Gewebeproben) erfasst werden. Proben müssen immer vor Gabe von Antibiotika entnommen werden. Mit anhaltendem Infektionsgeschehen und der damit einhergehenden Abnahme der Erregerlast nimmt jedoch die Wahrscheinlichkeit, den Erreger mittels PCR nachweisen zu können, ab.
Direkte Nachweisverfahren
Es stehen mehrere direkte Verfahren für den direkten Leptospiren-Nachweis zur Verfügung. Methode der Wahl ist die PCR, die anderen Methoden spielen kaum noch eine Rolle.
-
Polymerase-Kettenreaktion (PCR): Sensitivste Methode. Insbesondere geeignet am Anfang der Infektion, bei chronisch infizierten oder geimpften Hunden und asymptomatischen
Dauerausscheidern.
Die Leptospiren-DNA kann zumeist in den ersten zehn Tagen der Erkrankung mittels PCR im Blut nachgewiesen werden. Mit fortschreitender Dauer der Infektion nimmt die Zahl der Bakterien im Blut ab, im Harn jedoch zu, und lassen sich dort bis zu 3 Wochen länger nachweisen. Da der genaue Zeitpunkt der Infektion meist unbekannt ist, sollten am besten sowohl Blut als auch Harn mittels PCR untersucht werden.
Nachteil: Bei einer zu geringen Anzahl an Bakterien reagiert der Test falsch negativ. Ebenso bereits 24 Stunden nach Gabe eines Antibiotikums.
Die Befunde der PCR sollten daher immer zusammen mit dem klinischen Zustand und den Symptomen des Patienten interpretiert werden. - Mikroskopie: Der mikroskopische Nachweis der Erreger kann aus Harn, Blut, Liquor, Organmaterial, Dialysat- beziehungsweise Körperhöhlenflüssigkeit gewonnen werden. Es sind mindestens 104 Leptospiren/ml Probenmaterial notwendig, um sie bei der Dunkelfeldmikroskopie wahrnehmen zu können. Zu falsch positiven Ergebnissen kann es kommen, wenn Fibrin oder Proteinfäden sowie andere Spirochäten (zum Beispiel Maulhöhlen-Treponema spp.) fälschlicherweise mit Leptospiren verwechselt werden. Dadurch hat die mikroskopische Diagnostik heute keine Bedeutung mehr.
- Kulturelle Isolierung: Proben für die kulturelle Anzucht von Leptospiren können aus Körperflüssigkeiten wie Harn, Blut, Liquor und aus Gewebeproben entnommen werden. Die Kultur ist für der Routinediagnostik nicht geeignet, da Leptospiren extrem langsam wachsen und die kulturelle Anzucht sehr aufwändig und anfällig für Kontaminationen ist.
Nur im positiven Fall gelten direkte Nachweisverfahren als beweisend!
Indirekte Nachweisverfahren
-
MAT: Der MAT gilt als der Goldstandard bei der Diagnose der Leptospirose. Laut Empfehlungen der World Health Organization (WHO), sollte der Test mindestens 19 Serovare,
welche 16 verschiedenen Serogruppen angehören, umfassen. Außerdem sollten die im MAT verwendeten Serovare der geographischen Region und den dort vorkommenden Leptospiren entsprechen. Der Test
ist lediglich serogruppen- und nicht serovarspezifisch, da die Antikörper der Serovare innerhalb der gleichen Serogruppe stark kreuzreagieren können. Aus diesem Grund sollte mindestens ein
Serovar der apathogenen Spezies L. biflexa verwendet werden, da die Antikörper ebenso mit den saprophytären Serovaren kreuzreagieren können, obwohl sie eigentlich gegen die pathogenen
Serovare gerichtet sind.
Für eine gesicherte Diagnose mit dem MAT werden zwei Serumproben im Abstand von ein bis zwei Wochen untersucht. Ein vierfacher Titeranstieg bei einem nicht aktuell geimpften Tier gilt als beweisend für eine vorangegangene Infektion.
Problematik: Eingeschränkte Vergleichbarkeit und Reproduzierbarkeit von MAT-Ergebnissen bei verschiedenen Laboranbietern. Außerdem ist der MAT nicht standardisierbar, da lebende Kulturen benötigt werden.
Der MAT gilt jedoch insgesamt, im Vergleich zu anderen Testsystemen, als der serologische Test mit der höchsten Sensitivität und Spezifität, was den häufigen Einsatz in der Diagnostik erklärt.
-
Enzyme-Linked Immunosorbent Assay (ELISA): Die meisten klinischen Fälle beim Hund werden mittels serologischer Nachweisverfahren diagnostiziert. Antikörper sind fünf bis
sieben Tage nach Ausbruch der Symptome im Blut nachweisbar.
Der IgM Antikörpernachweis mittels Schnelltest kann als erstes Screeningverfahren eingesetzt werden, ist aber nur im positiven Fall ein Hinweis auf eine aktuelle Infektion.
Der ELISA ist standardisierbar, schnell, einfach, und die Auswertung erfolgt photometrisch. Es gibt IgG und IgM spezifische ELISA und jene, die beides nachweisen. Innerhalb der ersten Woche post infectionem (p. i.) steigen die spezifischen IgM-Ak an, erreichen den höchsten Wert zwei Wochen p. i. und fallen danach wieder ab. IgG-Ak hingegen steigen zwei Wochen p. i. an und fallen vier Wochen p. i. wieder ab. IgG-Ak steigen nach einer Impfung deutlicher an und halten über Monate einen konstant hohen Titer. Bei nur einer Serumprobe stellt daher die Verwendung eines kombinierten IgG/ IgM-ELISA eine geeignet Alternative zum MAT dar, um zwischen einer akuten Infektion (IgM-Anstieg) oder einer länger zurückliegenden Impfung zu unterscheiden. - Schnelltests: Die Aussagekraft der aktuell verfügbaren Tests ist noch unklar.
Weitere diagnostische Verfahren im Krankheitsverlauf
- Abdomen-Sonographie (veränderte Nieren)
- Röntgen Thorax (z.B. typische Lungenmuster bei LPHS)
Die Therapie
Möglichst Sicherung von Probenmaterial vor Einleitung der Behandlung.
Antibiose
Doxycyclin: 10 mg/kg KGW 1 x täglich p.o. oder 5 mg/kg KGW 2 x täglich p.o. für mindestens 21 Tage
Cave: Anorexie, Erbrechen, Anstieg der Leberenzyme
Amoxicillin: 20 mg/kg KGW 3 x täglich p.o. für 28 - 31 Tage
Cave: Nur Stopp der Erregerausscheidung über den Urin nach 24 Stunden, keine Erregereliminierung.
Symptomatische Behandlung
- Dehydration und hypovolämischem Schock: massive intravenöse Infusionstherapie entgegenwirken.
- Erbrechen: Antiemetika
- Urämische Gastritis: Protonenpumpenhemmer
- Schmerzen des Abdomens: Analgetika
Spezielle Behandlung
- Invagination: Operation
- DIC: Plasma-Transfusionen (fresh-frozen Plasma oder frisch gewonnene Plasmaspenden)
- LPHS-Patienten: Atmung muss streng überwacht werden. Sauerstoffzufuhr. Die Gabe von Steroiden, zur Reduktion der die Lungenschäden verursachenden Immunreaktion, wird bei Hunden kontrovers diskutiert.
Eine schwer verlaufende Leptospirose erfordert eine intensivmedizinische Betreuung (mehrmalige Kontrolle der Vitalparameter, Blutdruck, zentraler Venendruck, Körpergewicht). Die Nierenfunktion
und Harnproduktion werden optimalerweise über ein geschlossenes Harnkathetersystem gemessen und reduziert damit gleichzeitig die Umgebungskontamination. Regelmäßige Blutkontrollen (Hämatokrit,
Nierenparameter, Thrombozyten und Elektrolyte) sind notwendig, um den Krankheitsverlauf zu verfolgen. Vorsicht ist hier bei Jungtieren oder kleinen Hunderassen geboten, da oftmalige Blutabnahmen
bei anämischen Hunden eine weitere Reduktion des Hämatokrit bewirken.
Bei der caninen Leptospirose ist eine intensive Therapie zur Unterstützung der Nierenfunktion (bis hin zur Dialyse) essenziell, da im späteren Verlauf der Erkrankung ein renales Wash-out Phänomen
mit plötzlicher Polyurie und Elektrolyt-Verlust auftreten kann. In diesem Fall ist die Infusionsrate anzupassen und Elektrolyte sind entsprechend der Verluste zu substituieren.
Die enterale Ernährung sollte so früh wie möglich über Ernährungssonden erfolgen. Rekonvaleszente Hunde können chronische Nieren- und/oder Lebererkrankungen entwickeln. Regelmäßige Kontrollen in
den folgenden sechs bis zwölf Monaten sind daher angezeigt.
Haushalt mit mehreren Hunden und Katzen
Eine prophylaktische Gabe von Doxycyclin bei Hunden, die mit erkrankten Tieren im selben Haushalt leben, wird zwar empfohlen, aber auch kritisch hinterfragt.
Aufgrund des zoonotischen Potenzials der Leptospiren, sind Hygienemaßnahmen wie Handschuhe und Schutzkleidung sowie Schutzbrillen beim Reinigen der Käfige und Ausläufe sowie beim Umgang mit den Tieren oder deren Ausscheidungen angebracht. Spritzwasser und Wasserdampf sollten hierbei vermieden werden. Urin-kontaminierte Umgebung ist zuerst mit trockenem Papier und Reinigungsmittel, anschließend mit jodhaltigen Desinfektionsmittel zu säubern. Kontaminierte Materialien sind sicher zu entsorgen und dürfen nicht in die Umwelt gelangen.
Die Prophylaxe
Impfung
Ein weiteres Plus der Impfung ist die Verhinderung des Ausscheidens von Leptospiren klinisch inapparenter Hunde. Die Verbreitung durch diese Hunde wird verhindert und das Zoonoserisiko gesenkt.
Beim Hund gehört die Leptospiroseimpfung zu den sogenannten Core-Impfungen, d.h. jeder Hund sollte zu jeder Zeit gegen Leptospirose geimpft sein. Geimpft wird ab der 8. Lebenswoche. Nach der ersten Impfung wird diese nach 3-4 Wochen, dann nach einem Jahr und danach jährlich wiederholt. Dies gilt auch für ältere Hunde.
Bei Umstieg von einem alten bivalenten Impfstoff auf einen neuen tetravalenten Impfstoff oder einer Impflücke länger als 18 Monate findet eine erneute Grundimmunisierung statt.
Idealerweise findet die Impfung im Frühjahr statt, um den Hund während der kritischen Jahreszeiten optimal zu schützen.
Es gibt Hinweise darauf, dass nach der Anwendung von Impfstoffen mit drei oder vier Leptospiren-Komponenten die Häufigkeit von Nebenwirkungen etwas höher ist als mit den bivalenten Leptospirenimpfstoffen. Bei bekannter Unverträglichkeit sollte ggf. auf diese bivalenten Impfstoffe ausgewichen werden. Da aber die Leptospirose derzeit vorwiegend durch andere Serovare als Icterohaemorrhagiae und Canicola verursacht wird, wird grundsätzlich zu einer Verwendung der neueren Leptospirosempfstoffe mit drei oder vier Leptospira-Komponenten geraten.
Ein weiteres Plus der Impfung ist die Verhinderung des Ausscheidens von Leptospiren klinisch inapparenter Hunde. Die Verbreitung durch diese Hunde wird verhindert und das Zoonoserisiko gesenkt.
Management
- keine Aufnahme von Nagetieren
- kein Trinken oder Baden aus, bzw. in stehenden oder sehr langsam fließenden Gewässern
Die Bedeutung als Zoonose
Je nach Vorkommen der Reservoirwirte kann sich der Mensch mit vielen verschiedenen Serovaren infizieren und fungiert dabei immer als Zufallswirt.
Die Inkubationszeit beträgt fünf Tage bis zwei Wochen. Danach kommt es zuerst zu milden fieberhaften Symptomen. In dieser Phase werden zuerst IgM-Antikörper gebildet, die in Schnelltests nachgewiesen werden. Später erfolgen die meisten Diagnosen mit dem MAT und dem Nachweis von bestimmten Serovaren zuordbaren IgG/IgM-Titern.
Unbehandelt kommt es, je nach Virulenz des Serovars, der Bakterienmenge und der gebildeten spezifischen AK zur Besiedelung und Schädigung weiterer Organe.
Die schwerwiegendsten Formen der humanen Leptospirose sind LPHS und Morbus Weil. LPHS verursacht schwere Blutungen in der Lunge und somit den Untergang des Gewebes, was unbehandelt innerhalb von 72 Stunden zum Tod führen kann. Letzteres weist eher unspezifische Symptome zusammen mit Ikterus und Splenomegalie auf. Akute Niereninsuffizienz, Thrombozytopenie und Hämorrhagien können folgen. Die Mortalitätsrate liegt bei Morbus Weil zwischen 5 Prozent und 15 Prozent, bei LPHS sogar bei 30 bis 70 Prozent. Weltweit erkranken jährlich etwa 853.000 Menschen an Leptospirose, wovon circa 5 Prozent an der Infektion sterben.
Die meisten Infektionen erfolgen bei Erwachsenen in den Sommermonaten. Prädisponierende Faktoren sind Freizeitaktivitäten oder Gartenarbeiten mit möglichem Kontakt zu Nagetieren, sowie der direkte Kontakt zu Hunden und Katzen.
Weiterführende Literatur und Links
s. Quellenangaben #Leptospirose
Behandlung Penicillin und seine Derivate (z. B. Ampicillin, Amoxicillin) sind in der ersten Phase der Erkrankung die Antibiotika der Wahl. Um das Trägerstadium (Niere) zu beenden, muss Doxycyclin für 2 Wochen gegeben werden. Die intensivmedizinische Betreuung der Patienten ist essentiell. Viele Patienten mit akuter Nierenschädigung benötigen Hämodialyse. Prophylaxe Die Reduktion der Umweltkontamination durch die Bekämpfung von Reservoirwirten, wie Mäusen und Ratten, ist so gut wie unmöglich. Daher ist eine Impfung von Hunden notwendig. In Deutschland verfügbare Impfstoffe enthalten zwei bis vier der Serovare Icterohaemorrhagiae, Canicola, Grippotyphosa und Australis. Nach einer Grundimmunisierung (zwei Impfungen im Abstand von 2 – 4 Wochen) muss eine jährliche Wiederholungsimpfung durchgeführt werden, da der Schutz der LeptospiroseImpfung wesentlich kürzer anhält als der Schutz gegen Virusinfektionen. Es gibt Hinweise darauf, dass 60 | Impfleitlinie für Kleintiere | StIKo Vet am FLI | Stand 01.01.2021 nach der Anwendung von Impfstoffen mit drei oder vier Leptospiren-Komponenten die Häufigkeit von Nebenwirkungen etwas höher ist als mit den bivalenten Leptospirenimpfstoffen. Bei bekannter Unverträglichkeit sollte ggf. auf diese bivalenten Impfstoffe ausgewichen werden. Da aber die Leptospirose derzeit vorwiegend durch andere Serovare als Icterohaemorrhagiae und Canicola verursacht wird, wird grundsätzlich zu einer Verwendung der neueren Leptospirosempfstoffe mit drei oder vier Leptospira-Komponenten geraten
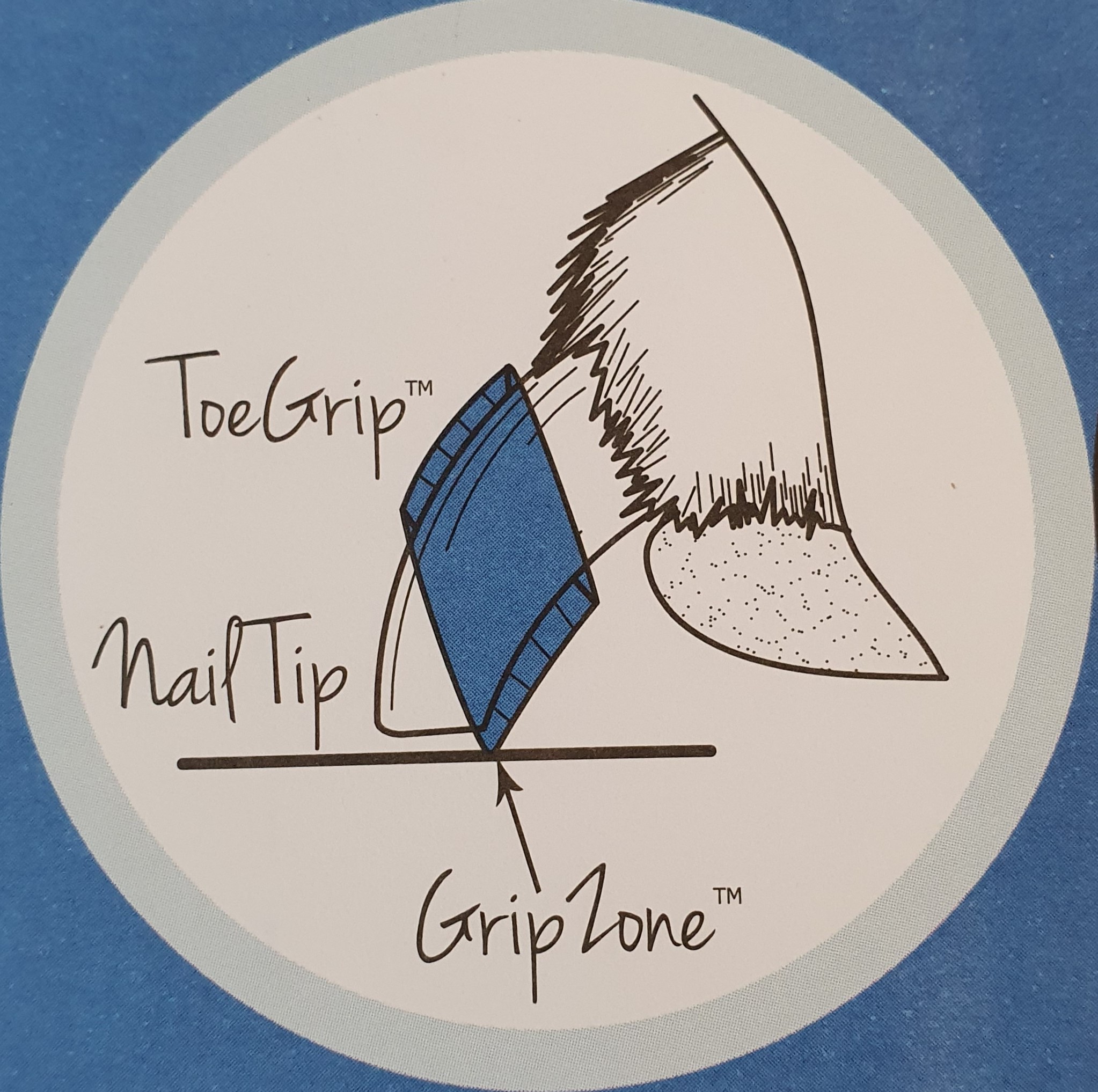
Kennen Sie einen Hund der schlecht aufstehen kann und unsicher läuft oder einen Hund mit Handicap?
ToeGrips, kleine Gummiringe die Hunden auf die Krallen aufgezogen werden, geben sofortigen Halt und Zutrauen. Ein ebenso einfaches wie geniales Produkt für alle gangunsicheren Hunde, älteren Hunde und Hunde mit Handicap.
Zuletzt bearbeitet
Juni 2021
Bitte beachten Sie auch den Disclaimer/Haftungsausschluss am Ende der Seite.